VALÈNCIA. Con las primeras palabras en las que anunciaba la aprobación de la primera vacuna europea contra la covid-19, la presidenta de la Comisión Europea, Ursula von der Leyen, desmentía a la farmacéutica BioNTech y Pfizer que días atrás se había arrogado todo el mérito y el peso de la investigación. “La primera vacuna europea contra la covid-19 es un producto europeo y estamos orgullosos de ello”, ha defendido la presidenta, recordando los millones de euros dados en investigación y los créditos concedidos por sus instituciones a Pfizer. Esta vacuna acaba de ser recomendada por la Agencia Europea del Medicamento para mayores de 16 años.
“La Unión Europea ha invertido nueve millones de euros para la investigación de Pfizer en la última década y 100 millones en préstamos del Banco Europeo de Inversiones (BEI) desde junio”, manifestó Von der Leyen. Y añadió que la UE “ha ayudado a la fabricación de la vacuna”, invirtiendo otros “100 millones de euros” para su compra y distribución por “otros países del mundo” que no pueden sufragarlas.
Von der Leyen insistió en que la vacuna de Pfizer “es un éxito para la Unión Europea” y garantizó que comenzaría a distribuirse antes de final de año, tras el anuncio el lunes de su aprobación por la Agencia Europea del Medicamento (EMA, por sus siglas en inglés). La autorización para su distribución se ha adelantado a la fecha prevista inicialmente para el próximo 29 de diciembre.
Así, declaró, Von der leyen, “hemos autorizado la primera vacuna contra la covid-19 para todo el mercado de la Unión Europea, para que todos tengan acceso a una vecina segura y eficaz al mismo tiempo”. La presidenta explicó que lo que primero que hará Pzifer es comenzar a producirla en su fábrica de Bélgica en los próximos días. Estamos en esto todos juntos”. Y añadió que “llegará a partir de los días 27, 28 y 29 de diciembre, para terminar un año tan difícil y cerrar una página de la covid-19”.
Distribución de 200 millones de dosis
La Comisión, los Estados miembros y la empresa están trabajando ahora para la entrega de las primeras dosis el 26 de diciembre, para que los días de vacunación de la UE puedan comenzar los días 27-28-29 de diciembre. Las entregas continuarán en diciembre y de forma semanal constante durante los meses siguientes. Está previsto que la distribución de los 200 millones de dosis esté completa en septiembre de 2021. La Comisión y los Estados miembros están trabajando para activar los 100 millones de dosis adicionales.
Días atrás, el Ministro de Salud alemán, Jens Spahn, criticó que la primera vacuna europea llegara antes a Estados Unidos, que hace una semana ya comenzó a vacunar, cuando la fábrica de Pfizer está a escasos kilómetros de Bruselas, la capital belga y sede del gobierno europeo. Ello obligó a adelantar la reunión del comité de expertos de EMA y a agilizar el procedimiento, que establecía unos plazos de consulta y comunicación a los Estados miembros de 67 días, reduciéndolos a tres días.
Éste será el mismo procedimiento que se usará para la aprobación de la segunda vacuna, la del laboratorio norteamericano Moderna, cuya aprobación también ha adelantado sus plazos. Según constató la presidenta Von der leyen, el comité de la EMA se reunirá el próximo 6 de enero, en lugar del 12 como estaba previsto. “Si se prueba que es segura, la EMA dará su opinión sobre Moderna el 6 de enero”.
Ante esta polémica, Pfizer había negado haber recibido ninguna subvención de la UE para la vacuna. De hecho, la multinacional estadounidense Pfizer dijo haber desarrollado su vacuna contra el coronavirus “sin recibir dinero público para actuar con rapidez y no ser esclava de la burocracia, porque la subvención siempre viene con ataduras”. La multinacional estadounidense invirtió 1.500 millones de dólares en su fármaco asumiendo que un fracaso correría de su bolsillo para no tener que aceptar una producción a precio de coste impuesta por el gobierno norteamericano.
Sin embargo, su socia alemana sí que había aceptado 375 millones del gobierno de Angela Merkel, de aquí la crítica del Ministro de Sanidad alemán y el menor precio de su comercialización en Europa. A ello se suman el resto de subvenciones y créditos de la Unión Europea, además de los precontratos que ataban a la UE desde este verano con la compra de millones de dosis incluso antes de finalizar la investigación.
Se llama Comirnaty
El anuncio, pues, ha llegado durante la mañana, con el comunicado de la EMA recomendando otorgar una autorización de comercialización condicional para la vacuna Comirnaty, desarrollada por BioNTech y Pfizer, “para prevenir la enfermedad por coronavirus 2019 en personas a partir de los 16 años”. La opinión científica de la EMA allana el camino para la primera autorización de comercialización de una vacuna contra la covid-19 en la UE por parte de la Comisión Europea, con todas las garantías, controles y obligaciones que ello conlleva.
El Comité de Medicamentos Humanos (CHMP, por sus siglas en inglés) de la EMA ha completado su rigurosa evaluación del Comirnaty, “y ha llegado a una conclusión de consenso, por la que se aprueba que ahora se dispone de datos suficientemente sólidos sobre la calidad, seguridad y eficacia de la vacuna para recomendar una autorización de comercialización condicional formal”, expone la EMA en su comunicado. “Esto proporcionará un marco controlado y sólido para respaldar las campañas de vacunación en toda la UE y proteger a sus ciudadanos”, añade.
“Las noticias positivas de hoy son un importante paso adelante en nuestra lucha contra esta pandemia, que ha causado sufrimiento y dificultades a muchos”, dijo Emer Cooke, Director Ejecutivo de EMA. “Hemos logrado este hito gracias a la dedicación de científicos, médicos, desarrolladores y voluntarios de ensayos, así como a muchos expertos de todos los Estados miembros de la UE”. Y añadió que “nuestra evaluación exhaustiva significa que podemos asegurar con confianza a los ciudadanos de la UE la seguridad y eficacia de esta vacuna, y que cumple con los estándares de calidad necesarios”.
Un ensayo clínico con 44.000 personas
Un ensayo clínico muy amplio demostró que Comirnaty fue eficaz para prevenir la covid-19 en personas, a partir de los 16 años. El estudio se realizó experimentalmente en 44.000 personas en total. La mitad recibió la vacuna y la otra mitad recibió una inyección ficticia. La gente no sabía si había recibido la vacuna o la inyección ficticia.
La eficacia se calculó en más de 36.000 personas a partir de los 16 años que no presentaban signos de infección previa, incluidos los mayores de 75 años. El estudio mostró una reducción del 95% de los casos sintomáticos de covid-19, en las personas que recibieron la vacuna. Mientras que ocho casos de 18.198 presentaron síntomas de covid-19, en comparación con las personas que recibieron una inyección simulada. En este caso fueron 162 de 18.325 los que recibieron “síntomas” de covid-19. Ello significa que la vacuna demostró una eficacia del 95% en el ensayo clínico.
El ensayo también mostró una eficacia de alrededor del 95% en los participantes con riesgo de COVID-19 grave, incluidos aquellos con asma, enfermedad pulmonar crónica, diabetes, presión arterial alta o un índice de masa corporal ≥ 30 kg / m2. La alta eficacia se mantuvo en todos los géneros, grupos raciales y étnicos.
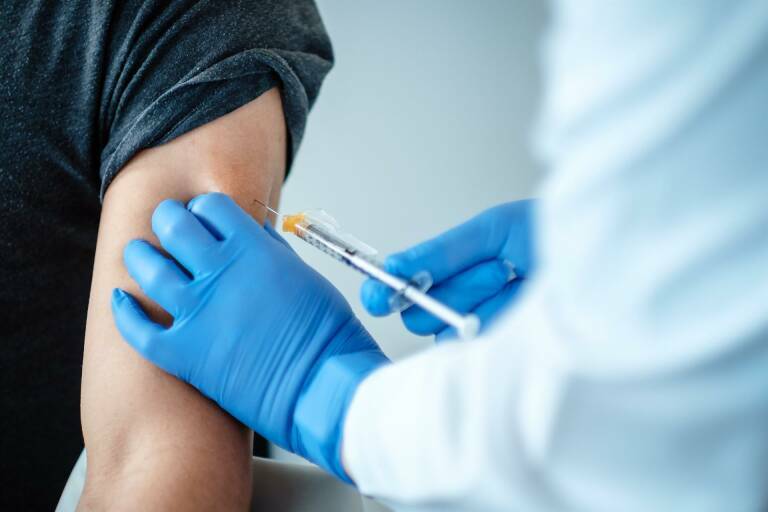
Dos inyecciones en el brazo
Comirnaty se administra en dos inyecciones en el brazo, separadas por al menos 21 días. Los efectos secundarios más comunes con Comirnaty fueron generalmente leves o moderados y mejoraron unos días después de la vacunación. Incluyeron dolor e hinchazón en el lugar de la inyección, cansancio, dolor de cabeza, dolor muscular y articular, escalofríos y fiebre. La seguridad y la eficacia de la vacuna se seguirán controlando a medida que se utilice en los Estados miembros, a través del sistema de farmacovigilancia de la UE y de estudios adicionales de la empresa y las autoridades europeas.
La autorización de comercialización otorgada por la Comisión Europea para la vacuna contra la covid-19 es condicional y se denomina CMA, por sus siglas en inglés. Esta autorización, la primera para toda la UE, sigue una recomendación científica positiva basada en una evaluación exhaustiva de la seguridad, eficacia y calidad de la vacuna por parte de la EMA y está respaldada por los Estados miembros. La presidenta Von der Leyen insistió en que las vacunas “estarán disponibles para todos los países de la UE, al mismo tiempo y en las mismas condiciones” y Stella Kyriakides, Comisaria de Salud y Seguridad Alimentaria, añadió que, además, serán unas “vacunas asequibles para todos los Estados miembros”.
Fragmentos inofensivos de proteínas virales
BioNTech y Pfizer presentaron una solicitud formal para una autorización de comercialización condicional el 1 de diciembre. Su investigación ha sido seguida por la EMA a través de una "revisión continua" desde el 6 de octubre, dando lugar a la agilización del proceso de autorización.
Este procedimiento, diseñado específicamente para situaciones de emergencia, garantiza una evaluación lo más rápida posible al tiempo que garantiza que todos los requisitos en términos de seguridad, eficacia y calidad de la vacuna se evalúen completa y minuciosamente. Sobre la base del dictamen positivo de la EMA, la Comisión ha verificado todos los elementos que respaldan la autorización de comercialización, y ha consultado a los Estados miembros antes de conceder la autorización de comercialización condicional.
La vacuna BioNTech / Pfizer se basa en la tecnología de ARN mensajero (ARNm). Esto permite que las células fabriquen fragmentos inofensivos de proteínas virales que el cuerpo humano utiliza para desarrollar una respuesta inmune para prevenir o combatir infecciones naturales posteriores.
Cuando a una persona se le administra la vacuna, sus células leerán las instrucciones genéticas y producirán fragmentos de la "proteína de punta", una proteína en la superficie externa del virus que utiliza para ingresar a las células del cuerpo, replicarse y causar enfermedades. El sistema inmunológico de la persona entonces tratará esta proteína como extraña y producirá defensas naturales (anticuerpos y células T) contra ella.





















